의료기기 수출에 적신호가 커졌다. 수출 의료기기에 포함된 소프트웨어(SW) 성능이 국제 시험평가 기준에 못 미치기 때문이다.
21일 정부기관과 관련 업계에 따르면 우리나라를 포함해 미국, 유럽 등에서는 의료기기 인허가 과정에서 SW 시험평가 자료 제출을 의무화한다. 의료기기 SW 탑재 비중이 높아지면서 안전성이 이슈로 대두됐기 때문이다. 환자감시장치, 초음파진단장비 등 일부 의료기기는 SW 탑재 비중이 30~40%에 이른다.
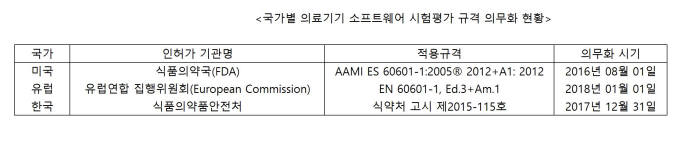
가이드라인 성격이 강한 의료기기 SW 시험평가 규격은 미국을 시작으로 의무화 추세다. 미국 식품의약국(FDA)은 지난해 8월 1일부터 국제표준규격 기반의 'AAMI ES 60601-1'을 강제했다. 메이저, 모더레이트, 마이너 등 세 등급으로 나눠 각 요구 사항에 대한 시험평가 자료를 의무로 제출해야 한다.
유럽연합(EU) 집행위원회도 내년부터 의료기기 SW 시험평가 규격 'EN 60601-1, Ed.3+Am.1'을 의무화한다. 유럽 국가 수출에 의무 사항인 CE 인증을 받기 위해서는 SW 시험평가 규격을 충족시켜야 한다. 검증을 통해 안전 등급을 클래스 C, B, A 등으로 분류해 허가한다. 우리나라도 오는 12월 31일부터 전자의료기기 기준 규격에 따라 SW 시험평가 자료를 국제 규격 수준에 맞춘다. 'IEC 60601-1'을 포함해 'IEC 62304'까지 강제시킨다.
의료기기 업계의 대응은 초보 단계다. 하드웨어(HW) 중심의 의료기기 산업 구조가 고착화돼 의료기기 SW 전문가를 찾기 어려운 실정이다. 영세 기업이 대다수로 SW 개발자, 인허가 전문가를 보유한 곳도 드물다. 국제 표준, 인허가 동향, 실무를 담당할 인력 확보는 요원하다.
한국산업기술시험원(KTL) 관계자는 “국내 의료기기 기업은 SW 밸리데이션(시험평가) 개념이 거의 없다”면서 “기업은 물론 정부도 HW에 초점을 맞춰 SW 국제 규격에 제대로 대응을 못하고 있다”고 지적했다.
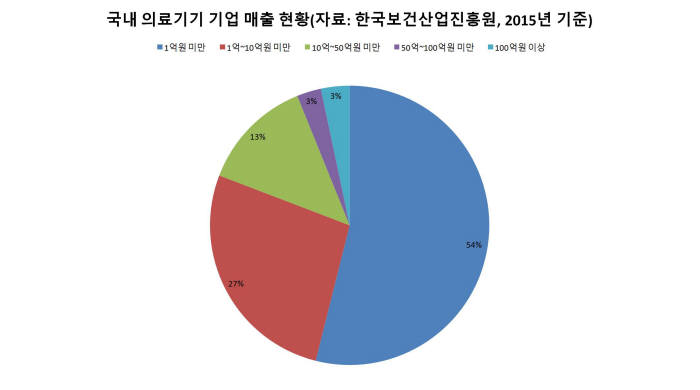
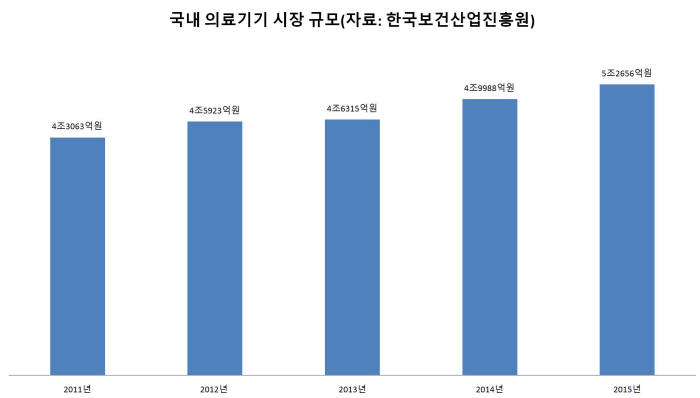
2015년 기준 우리나라 의료기기 시장 규모는 5조2656억원이다. 제조기업 수는 2992개다. 이 가운데 연매출 10억원 미만 기업은 절반이 넘는다. 50억원 미만 기업까지 포함하면 전체의 80%(2418개)에 이른다.
업계는 내수 시장을 넘어 해외 시장에 사활을 걸고 있다. 업계가 국제 규격에 대응하지 못하면 규격 자체가 무역 장벽으로 작용할 가능성이 있다. 의료기기 기업 70%는 SW 개발·관리를 외주에 의존하고 있는 실정이다. 외주도 한계가 있다. 의료기기 SW 시험평가 규격 'IEC 62304'는 설계, 개발, 검증 등을 포함한 전 주기 방법론이다. 인증 대상 기업이 설계 단계부터 자료를 확보하지 않으면 평가가 어렵다. 문제 발생 시 대응도 어렵다.
중소기업 대상 인허가 교육이 요구된다. 의료기기 SW 시험평가 교육은 KTL, 원주의료기기테크노밸리, 의료기기협동조합 등에서 부분적으로 실시한다. 체계적이고 연속적 교육 프로그램이 없다. 의료기기 분야 개발·인허가 전문가 양성이 절실하다.
허영 한국산업기술평가관리원 메디칼디바이스 PD는 “정부에서도 새로운 국제 규격 교육을 강화하지만 의료기기 SW 특화 교육은 없다”면서 “장기적으로 부족한 의료기기 분야 SW 인력을 양성하고 단기적으로 정보기술(IT) 기업과 의료기기 기업이 협업하는 방안을 찾아야 한다”고 말했다.
정용철 의료/SW 전문기자 jungyc@etnews.com









