국내 연구진이 크리스퍼 유전자가위의 핵심 단백질 표적 탐색 및 절단 메커니즘을 규명했다. 유전자 치료와 종자 개량 등 생명공학기술 발전에 기여할 전망이다.
광주과학기술원(GIST·총장 문승현)은 이상화 고등광기술연구소 박사팀이 정철현 한국과학기술연구원(KIST) 테라그노시스 연구단 박사팀, 배상수 한양대 화학과 교수팀과 공동으로 단일분자 형광 이미징 기술을 이용해 크리스퍼 유전자 가위의 핵심 단백질 Cas12a의 표적 DNA를 탐색 및 절단과정을 규명했다고 24일 밝혔다.
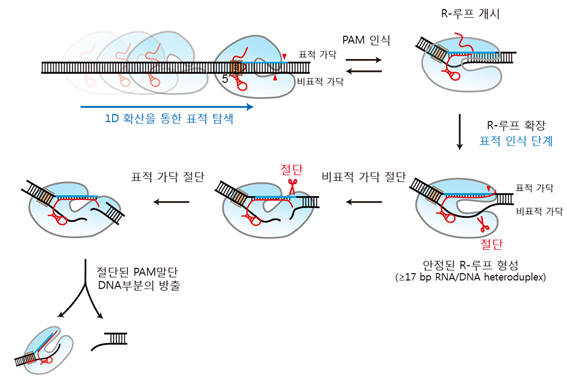
크리스퍼 유전자가위는 잘못된 유전자를 잘라 내 문제를 해결하는 차세대 유전자 교정 기술이다. 하지만 크리스퍼 유전자가위는 표적 DNA와 유사한 염기서열을 갖는 DNA까지도 잘라 의도치 않은 변이를 유발하는 표적이탈효과 등이 문제점으로 지적되고 있다. 아직까지 인간 유전자질환 치료에 직접 적용하기엔 위험 부담이 큰 상황이다.
연구팀은 크리스퍼 유전자가위의 핵심 단백질인 Cas9의 변종으로 표적 특이성이 높은 Cas12a의 표적 탐색 및 절단 메커니즘을 단일분자 형광 이미징 기술을 이용해 실시간 관찰하는 데 성공했다. Cas12a 단백질이 긴 DNA에서 1차원 확산운동을 통해 특정 표적을 탐색하고, 표적 DNA와 만나 안정되게 결합한 뒤 비표적과 표적 가닥으로 시간 차를 두고 순차적으로 절단한다는 사실도 규명했다.
이상화 박사는 “이번 연구는 Cas9과 구별되는 Cas12a 단백질의 분자 기전을 제시함으로써 크리스퍼 유전자 교정기술의 향상에 밑거름이 될 것으로 기대한다”고 말했다.

광주=김한식기자 hskim@etnews.com