까다롭기로 유명한 미국 식품의약국(FDA)이 역대 최대 규모 신약승인을 예고했다. FDA 심사 프로세스를 효율화했다. 신약개발 업체도 후보물질 선택과 집중을 추구했다. 국산 신약 FDA 승인은 2014년 이후 명맥이 끊긴데다 올해 국내 허가받은 신약도 1개에 불과하다. 신약개발 분위기가 달아오르지만 글로벌 경쟁력을 확보하는데 긴 시간이 소요될 전망이다.
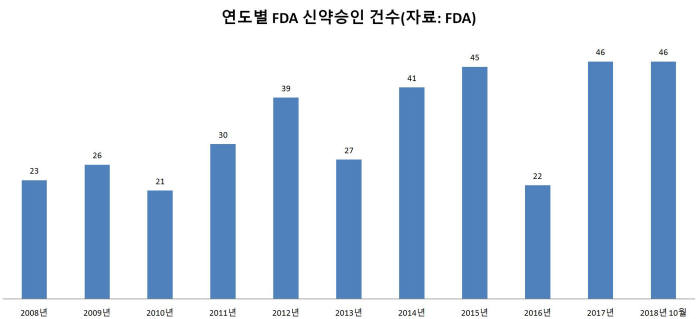
22일 기준 미국 FDA가 올해 승인한 신약은 총 46개다. 사상 최대치를 기록한 작년과 같다. 4분기 승인이 예정된 신약이 상당수인 것을 감안, 사실상 작년 실적을 뛰어넘어 역대 최고치를 기록할 것으로 예상된다.
FDA는 2013년까지 해마다 20~30개 신약을 승인했다. 2016년까지 연평균 31.2개 신약이 승인됐지만, 작년을 기점으로 대폭 확대됐다.
작년부터 이어진 신기록 행진은 FDA 심사 체계와 신약개발 업체 성장 영향이 크다. FDA는 검증 가능한 선에서 의약품 시장 심사·출시 효율화를 추구한다. 기업 간 경쟁을 유도하는 동시에 국민 보건 증진이 목표다. 실제로 FDA는 신속한 신약 승인을 위해 △패스트트랙 △혁신의약품 △지정·가속승인 제도를 운영한다. 작년 승인받은 신약 46개 중 61%(28개)가 신속한 승인 제도를 적용했다.
조헌제 한국신약개발연구조합 상무는 “치료제가 너무 비싸 대안이 필요하거나 시급하게 치료제가 요구되는 희귀의약품일 경우 FDA가 신속 승인제도로 시장에 공급한다”면서 “신약개발 기업이 비용 효율화를 위해 가능성 높은 후보물질을 중심으로 선택과 집중을 하는데다 희귀질환 등 영역을 세분화한 것도 FDA 신약승인이 확대되는 요인”이라고 분석했다.
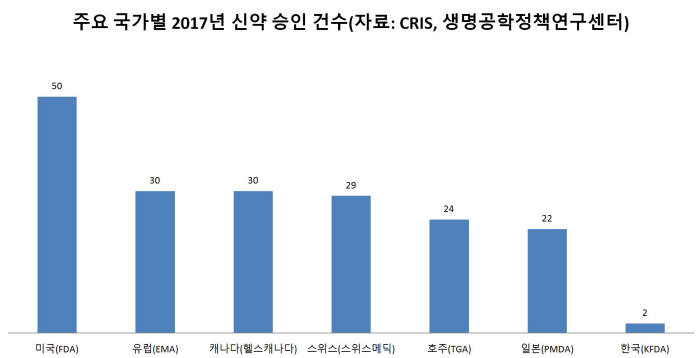
엄격한 FDA 관문이 넓어지고 있지만, 국내 기업은 여전히 통과에 애를 먹는다. 국산 신약이 FDA 허가를 받은 것은 2003년 LG생명과학(현 LG화학) '팩티브'와 2014년 동아에스티 '시벡스트로'가 유일하다. 둘 다 블록버스터급 신약과는 거리가 먼 항생제다.
우리나라 식품의약품안전처도 마찬가지다. 올해 식약처가 승인한 국산 신약은 CJ헬스케어가 개발한 위식도역류질환 치료제 '케이캡정'이 유일하다. 매년 1~2개 신약이 국내 허가를 받는다.

우리나라 신약 역량은 발전을 거듭하지만 세계 수준에 근접하기는 어렵다. 신약 개발 역사가 짧은데다 연구개발(R&D) 투자도 부족하다. 한미약품, SK케미칼 등은 수백억원이 투입되는 최종 인·허가 과정까지 밟기보다 임상2상 이상 결과물을 글로벌 제약사에 넘긴다.
그나마 최근 FDA 문을 두드리는 국산 신약이 늘었다. SK바이오팜 수면장애치료제가 이르면 연말 FDA 허가를 기대한다. 신라젠, 크리스탈지노믹스, 대웅제약, 녹십자 등도 FDA에 신약 허가 신청을 계획한다.
유승준 한국바이오협회 바이오경제연구센터장은 “세포치료제, 유전자치료제 등 니치마켓을 노린 신약 개발이 확대되면서 FDA 승인 문턱을 넘을 가능성이 높다”면서 “막대한 자금이 투입되는 임상3상 이후 과정을 정부가 지원해 우리나라를 대표할 신약을 개발해야 한다”고 주장했다.
[전자신문 CIOBIZ] 정용철 의료/바이오 전문기자 jungyc@etnews.com









