국내 연구진이 대장암 치료의 바이오마커 신뢰도와 내성 문제를 해결할 수 있는 단초를 찾았다. 향후 더욱 강력한 대장암 항암제 신약을 구현할 수 있는 기반을 마련했다.
한국과학기술원(KAIST·총장 신성철)은 조광현 바이오 및 뇌공학과 교수팀이 대장암 항암제 바이오마커와 치료 내성을 극복할 수 있는 병용치료 타겟을 찾아냈다고 7일 밝혔다.
대장암은 전 세계 환자 수가 100만명을 넘는 난치병이다. 국내에서도 최근 발병률이 급속하게 늘어나고 있다. 대장암 치료에도 암세포 내 특정 분자를 표적으로 삼아 치료하는 표적항암제가 쓰인다. 문제는 실제 효능이 기대보다 낮다는 점이다.
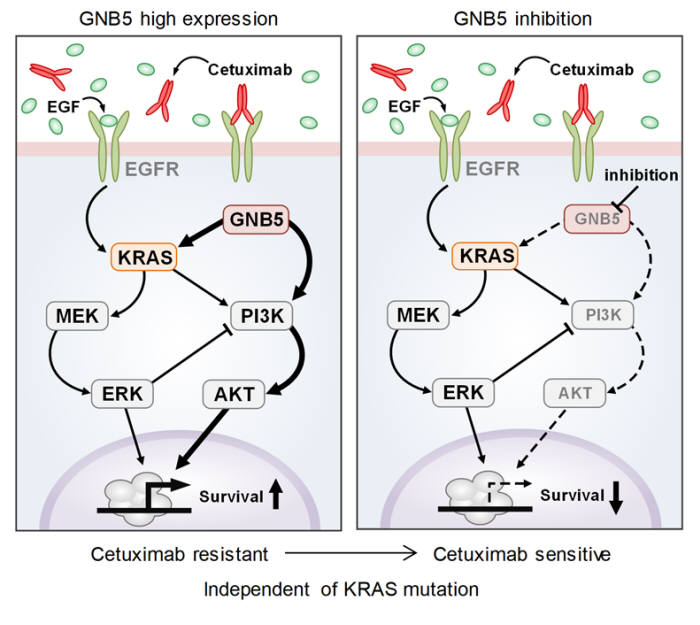
'세툭시맙'이 대표적인 대장암 치료제로, 치료 효능이 높을지 미리 가늠하는 '바이오마커'부터 신뢰성 확보가 어려웠다. 세툭시맙은 암세포 성장 신호를 전달하는 'KRAS 유전자' 돌연변이 여부를 바이오마커로 쓴다. KRAS 유전자가 돌연변이를 일으키지 않아 항암제 저항성이 없는 경우 세툭시맙을 쓰는데, 이때도 효능이 높지 않다. 오히려 KRAS 유전자가 돌연변이를 일으키는 반대 경우에도 치료 효능이 나타날 때도 있을 정도로 신뢰성이 높지 않다. 치료 효능도 클 수 없었다.
연구팀은 '시스템 생물학'을 이용해 새로운 대장암 치료 방법을 찾았다. 시스템 생물학은 수학모델링과 컴퓨터 시뮬레이션, 분자세포생물학 실험 등을 활용한 융합연구 패러다임이다. 이를 활용해 새로운 5개 유전자 바이오마커 DUSP4, ETV5, GNB5, NT5E, PHLDA1를 찾아냈다. 이들 유전자가 활성화되지 않을 때 세툭시맙 효능이 극대화 되고, 특히 GNB5를 억제하면 KRAS 돌연변이 여부와 상관없이 항암제 내성을 극복할 수 있다는 것을 밝혀냈다.
연구팀은 발굴 유전자를 표적화하는 신약개발로 새로운 대장암 치료전략을 제시할 수 있다고 설명했다.
조광현 교수는 “지금까지 GNB5 유전자 조절을 대장암 조합치료에 활용한 예는 없었다”며 “시스템 생물학으로 암세포 약제 내성 원리를 밝히고 새로운 병행치료 타겟을 발굴해 정밀의학 가능성을 제시했다”고 말했다.
대전=김영준기자 kyj85@etnews.com









