광열치료는 암 발생 부위에 금 나노입자를 전달한 후 레이저를 쪼여 암세포를 죽이는 암 치료법이다. 수술이나 화학치료법을 사용할 때 발생하는 고통과 부작용을 줄일 수 있어 새로운 치료 기술로 주목받고 있다. 그러나 금 나노입자는 체외 배출이 어려워 잠재적 위험을 안고 있다. 암 부위로의 정확한 전달도 어려워 정작 의료 현장에서는 광열치료법을 활용하기 어려운 실정이다.
국내 연구진이 이 같은 광열치료법 한계를 풀 실마리를 찾았다. 이지원 고려대 화공생명공학과 교수·김광명 한국과학기술연구원(KIST) 의공학연구소 박사 공동연구팀은 암세포에만 결합하는 나노신소재를 개발했다고 지난 9일 밝혔다.
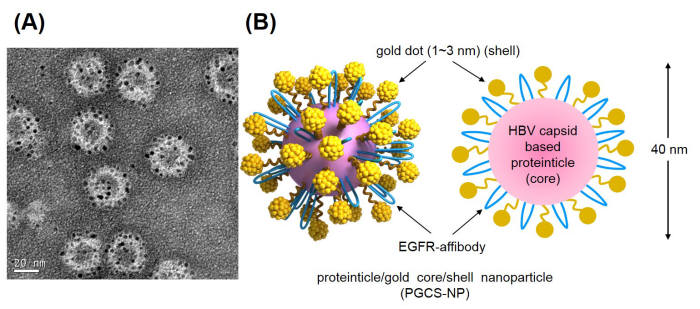
연구팀은 금 이온 환원용 펩타이드와 3나노미터(㎚) 초미세 금 나노닷이 함께 존재하는 단백질-금 복합 나노신소재를 개발했다. 암 세포에만 선별적으로 결합할 뿐 아니라, 자발적인 단백질 변성으로 해체돼 몸 밖으로 쉽게 배출된다. 나노 물질이 체내에 남아 부작용을 일으킬 수 있는 위험을 제거한 셈이다.
기존 광열치료법 연구에는 직경 20㎚ 금 나노입자가 주로 사용됐다. 체내 투과율이 높은 근적외선 레이저를 잘 흡수하고 광열효과가 뛰어나기 때문이다. 하지만 이 정도 크기의 금 나노입자는 체외로 잘 배출되지 않고 암 부위로의 정확한 전달도 어려웠다.
연구팀은 암세포에 선택적으로 결합할 수 있는 펩타이드를 표출시킨 40㎚짜리 단백질 나노입자를 대장균 세포 내에서 제조했다. 제조한 단백질 나노입자 표면에 다시 3㎚ 금 나노닷을 입혀 복합 나노신소재를 완성했다.
신소재를 활용한 쥐 실험에서는 뛰어난 전달력과 체외 배출 능력이 입증됐다. 연구팀은 우선 인간 유방암 세포로 생쥐에 종양을 유도했다. 생쥐 정맥에 나노신소재를 주입하자 기존 금 나노입자보다 암 발병 부위에 훨씬 효과적으로 전달됐다.
광열치료 효과도 그대로 나타났다. 암 세포에 레이저를 50분 간 쬐어준 뒤 5일 간 관찰한 결과 암세포 괴사가 확인됐다. 광열치료가 끝난 뒤 3주 간 생쥐의 장기와 조직을 조사했지만 금 나노닷은 남아있지 않았다. 금 나노닷 체외 배출이 확인된 것이다.
유방암, 피부암 등 근적외선 레이저가 투과할 수 있는 모든 종류의 암 치료에 활용할 수 있을 것으로 기대된다. 앞으로 전임상 및 임상시험을 거쳐야 실용화가 가능할 전망이다.
이 교수는 “선택적 전달 효능을 향상시켜 광열치료 효과를 극대화했다”며 “금 나노입자의 체내 축적으로 인한 문제를 해결할 실마리가 될 것”이라고 말했다.
연구는 미래창조과학부 중견연구자지원사업과 선도연구센터지원사업 지원으로 수행됐다. 연구 결과는 첨단재료 분야 국제학술지 ‘어드밴스드 머티리얼스’ 8일자에 소개됐다.
송준영기자 songjy@etnews.com







