의학이 고도로 발달한 현대에도 인간은 끊임없이 질병에 시달리고 또 죽어간다. 특히 생물과 무생물의 경계에 서 있는 바이러스는 인간의 최대 숙적이라 해도 과언이 아닐 것이다. 바이러스는 신종플루, 메르스, 조류독감처럼 최근 전 세계를 떠들썩하게 만들었던 질병의 주범이다. 지금 이 순간에도 많은 학자들이 바이러스를 퇴치하기 위해 연구에 매진하고 있지만 그 위협으로부터 자유롭기란 쉽지 않다.
![[KISTI 과학향기]인류 골칫거리 바이러스 잡는 원시 생명체의 신비](https://img.etnews.com/photonews/1709/992599_20170908143254_150_0001.jpg)
#바이러스가 인류에게 강적인 이유
바이러스가 인류에게 지속적으로 위협적인 이유는 퇴치가 어렵기 때문이다. 바이러스는 세균 여과기를 통과할 수 있을 정도로 크기가 작고 숙주 세포 밖에서는 무생물과 유사한 상태로 존재하기에 그 제어가 더욱 까다롭다.
더 큰 문제는 수많은 변이를 일으킨다는 점이다. 바이러스는 스스로 물질대사를 할 수 없기에 숙주 세포의 물질대사 시스템을 이용해야 한다. 번식을 위해 바이러스는 자신의 유전자를 숙주 세포의 염색체에 감쪽같이 끼워 넣었다가 다시 챙긴다. 이 과정에서 오류가 종종 일어난다. 엉뚱한 부위까지 갖고 간다거나 일부를 누락시키는 일이 많다.
때로는 숙주 세포의 면역체계가 바이러스가 끼워 넣은 부분을 공격해 바이러스의 유전자를 망가뜨리기도 한다. 많은 수의 병원성 바이러스는 유전물질로 안정한 DNA 대신 불안정한 RNA를 사용하기 때문에 유전정보가 외부 환경에 의해 쉽게 변조된다. 숙주 세포를 감염시킬 때마다 유전자 변화가 일어나니 특정한 항원을 인지해 공격하는 항원-항체 면역시스템으로는 대처하기가 어렵다. 유전자가 툭하면 바뀌니 '이건 바이러스가 끼워 넣은 것이 틀림없다!'라고 확실하게 말하기가 곤란한 것이다. 결국 바이러스에 맞서는 약물의 개발은 소 잃고 외양간 고치는 식이 될 수밖에 없다.
그러면 바이러스의 유전자가 숙주 세포에 침입했을 때 숙주 세포에 원래 없던 부분이 갑자기 보이면 바이러스의 것으로 의심하고 제거할 수 있지 않을까. 안타깝게도 어렵다. 유전자를 자칫 잘못 없앴다가는 숙주 세포가 위험해질 수 있기 때문이다. 무엇보다 이런 식으로 제거된 유전정보는 복원하기도 어렵다. 게다가 유전자에서 없애야 할 부분만 정확하게 없애는 방법도 최근에야 '크리스퍼'라는 이름으로 활용되기 시작했는데, 이마저도 100% 확실성을 보장하지는 못한다. 현재로서는 숙주에 침투한 바이러스를 제거하는 방법은 없는 것이나 마찬가지다.
#바이러스 물리칠 원시 생명체의 신비
그런데 나름 면역계가 충분히 발달하고 적응한 고등동물도 대처하기 어려운 바이러스에 대처하는 방법이 원시적인 형태의 생명체에서 발견돼 화제다. 과학저널 '네이처(Nature)' 6월 28일 자 온라인 판에는 원시적인 '항바이러스 방어체계(antiviral system)'를 이용한 새로운 치료제 전달 시스템이 소개됐다.
미국 마운트 사이나이 아이칸의대 연구팀은 인체 속 세포 안에 남아 있는 아주 오래된 방어체계에 주목했다. 이론상 다세포생물을 비롯해 단일 세포로 이뤄진 원핵생물, 고세균, 진핵생물에 이르기까지 모든 생명체는 바이러스의 숙주가 될 수 있기 때문에 오랫동안 바이러스에 대항하기 위한 방어기제를 준비해 왔다. 근 10억 년 동안 진행됐던 바이러스와 숙주의 전쟁은 인간의 세포 속에도 뚜렷한 흔적을 남겼다. 일종의 유전자 화석(genetic fossil)인 셈이다.
연구팀은 생물이 3세대에 걸쳐 이룩한 항바이러스 방어 시스템의 진화를 추적했다. 그 결과 원시적인 방어체계를 활용해 새로운 치료제 전달시스템을 개발할 수 있다는 결론을 도출했다.
#오래된 항바이러스 싸움꾼들
이 방어체계의 중심은 '드로셔(Drosha)'라는 단백질과 이를 포함한 'RNAse III 효소군(family of enzymes)'이다. 연구팀에 따르면 드로셔와 RNAse III은 원래 동물과 식물이 단세포 생물일 때부터 바이러스에 저항하던 싸움꾼이었다고 한다. 이들은 바이러스의 핵심인 유전물질(RNA, DNA)을 공략하는 방법으로 오랫동안 전투를 이끌어 왔다.
본래 박테리아의 RNA를 관리하는 단백질이었던 RNAse III은 바이러스의 유전물질도 제어할 수 있어 식물과 무척추동물에서 항바이러스 임무도 수행한다. 사람으로 치면 행정병이 전투 능력을 인정받아 최전방 격전지에 배치된 셈이다.
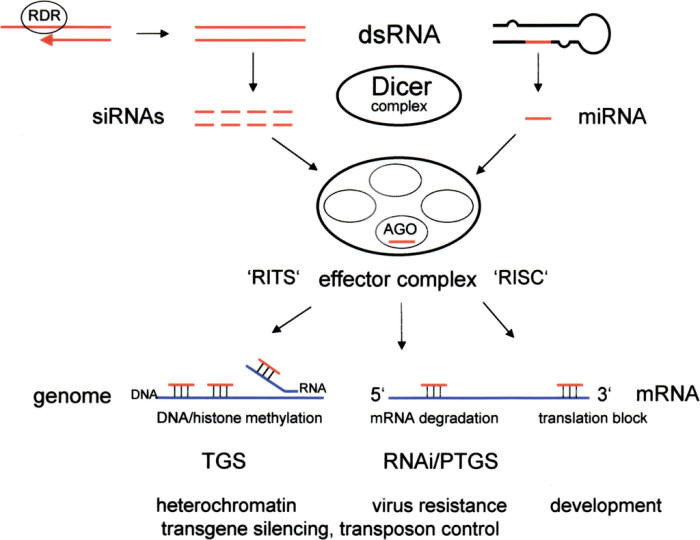
RNAse III이 바이러스에 대응하는 방법은 RNA간섭(RNAi)이다. RNA 간섭이란 RNA 중 일부가 짧은간섭RNA(siRNA)나 마이크로RNA(miRNA)가 전령RNA(mRNA)의 활성을 조절해서 유전자 발현을 방해하는 것을 말한다. 말 그대로 단백질 합성 정보를 담은 mRNA가 이제 막 단백질을 생산하려고 하는데 이를 '간섭'해서 막는 역할을 하는 것이다. 이렇게 mRNA의 발현을 막으면 바이러스가 기대하는 단백질의 합성을 막는 셈이다.
#유전자 가위로 바이러스 유전물질 난도질
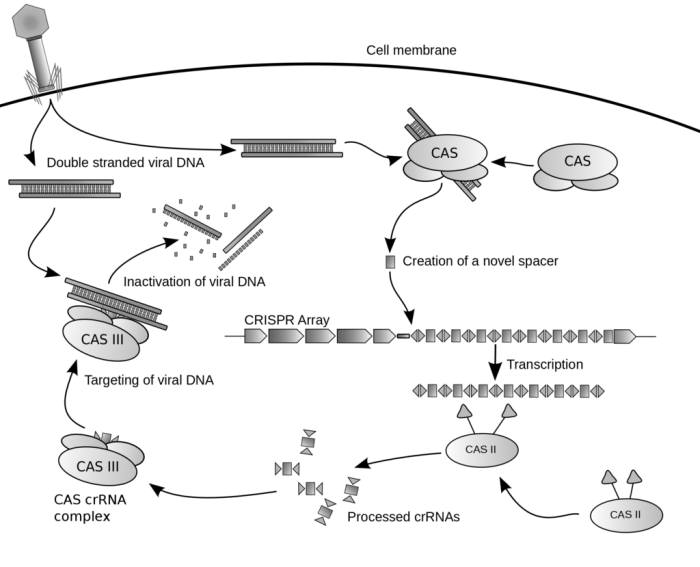
연구팀에 의하면 RNAse III이 이렇게 면역에 관여하는 현상은 모든 생명에서 나타나는 보편적 현상이라고 한다. 이번 연구의 선임저자인 벤자민 텐외버 박사는 이에 대해 모든 생물계의 방어시스템에서 RNAse III의 흔적을 볼 수 있다고 설명했다. 박테리아의 면역체계에서 찾아낸 '유전자 가위'인 크리스퍼 시스템도 RNAse III이 관여하는 영역에 속한다.
크리스퍼 시스템은 본래 바이러스로부터 자신을 지키기 위한 박테리아의 전략 중 하나다. 이전에 침입했던 바이러스의 DNA 일부를 자신의 유전체에 저장했다가 동일한 바이러스가 침입할 때 해당 DNA만을 찾아 자르는 것이다. 특정 유전자의 염기서열을 찾아가는 염기서열 조각을 절단 효소와 짝을 이뤄 완성한 것이 크리스퍼 시스템이다. 이 크리스퍼 시스템은 표적이 되는 DNA가 몸에 침투할 경우 염기서열에 달라붙어 정확하게 잘라낸다.
#투쟁심 잃지 않은 드로셔
한편 척추동물은 조금 다른 방법을 택했다. 바이러스를 물리치는 주 역할을 점차 인터페론(interferon)이라는 단백질에게 맡긴 것이다. 항바이러스 방어체계의 진화로 인해 단순한 RNAse III 기반 시스템의 효용성이 갈수록 떨어졌기 때문이다. 대신 척추동물은 RNAse III의 일부인 드로셔와 관련 단백질들에게는 본연의 임무인 유전자 조절(gene regulation)이라는 업무를 부여했다.
그런데 드로셔는 바이러스와 싸우던 투쟁심을 잃어버리지 않았다. 연구팀은 우연히 인간의 세포에 바이러스가 침입했을 때 드로셔가 핵(nucleus)에서 빠져나오는 모습을 보고 한 가지 가설을 세워봤다. 척추동물의 세포에 바이러스가 침입하면 드로셔는 이와 싸우기 위해 핵을 벗어난다는 것이다.
연구팀이 드로셔가 결핍된 세포를 바이러스에 감염시킨 결과 실제 바이러스의 증식이 더 빨랐다. 이후 세균에서 추출한 드로셔를 물고기, 인간에게 삽입했더니 유의미하게 바이러스의 증식이 줄어드는 현상이 나타났다. 이에 대해 텐외버 박사는 드로셔는 모든 항바이러스 시스템의 베타버전과 같다고 표현했다.

#온고지신의 지혜, 최첨단 과학에서도?
연구팀은 이 연구를 바탕으로 흥미로운 발상을 해냈다. 만약 세포 내에서 드로셔가 원시 RNAse III 기반 방어체계와 같은 역할을 하고 있다면 세포 안으로 특정 유전자를 전달하는 '전령 바이러스'도 만들 수 있지 않을까? 즉 외부에서 들어온 물질은 면역체계에 의해 세포에 닿기 한참 전에 격퇴되지만 면역체계를 우회할 수 있어 막기가 어려운 바이러스를 드로셔 방어체계에는 민감하게 만들면 세포 안까지 무사히 약물이나 유전자를 전달할 수 있지 않을까?
이에 연구팀은 '좋은' 바이러스를 이용한 벡터(특정 유전자를 표적 유전자까지 운반하는 매체)를 만드는 연구를 진행하고 있다. 목표는 RNAse III 기반 방어체계에 극히 민감한 '유전자 조작 바이러스(engineered viruses)'를 만들고 이를 이용해 원하는 형질을 담은 '자가복제 RNA(self-replicating RNAs)'를 조합해서 유전자 운반체를 만드는 것이다. 유전자 조작 바이러스의 민감성을 잘 조절하면 유전자를 편집하거나 치료물질을 전달하는 시간을 확보해서 유용하게 활용할 수 있을 것으로 기대된다.
옛말에 '온고지신(溫故知新)'이라 했다. 옛 것을 익히고 새 것을 안다는 뜻으로 과거 전통과 역사를 바탕으로 새로운 지식이 쌓아 진정한 앎을 얻는다는 뜻이다. 단세포 생물이었을 때의 본능적인 생존 시스템이 21세기에도 풀지 못한 난제를 해결하는 데 도움이 될지도 모른다고 생각하니 과학의 진리는 오묘하기만 하다.
글: 김청한 칼럼니스트







