대웅제약(대표 전승호)은 나보타(Prabotulinumtoxin A) 미국 3상 임상결과가 국제학술지 더마톨로직 서저리(Dermatologic Surgery)에 게재됐다고 밝혔다.
나보타는 지난 2월 미국 식품의약국(FDA) 판매허가를 획득한 대웅제약 자체개발 보툴리눔 톡신 제제다. 미국에서 미간주름 환자 654명을 대상으로 3상 임상을 두차례 진행했다. 해당 연구는 만 18세 이상 중등증 또는 중증 미간주름 환자를 대상으로 나보타와 위약을 동일 용량으로 1회 투여했다. 일정시점 이후 4단계 미간주름스케일(GLS)을 활용해 주름개선 효과를 확인하는 이중맹검 방법으로 진행했다.
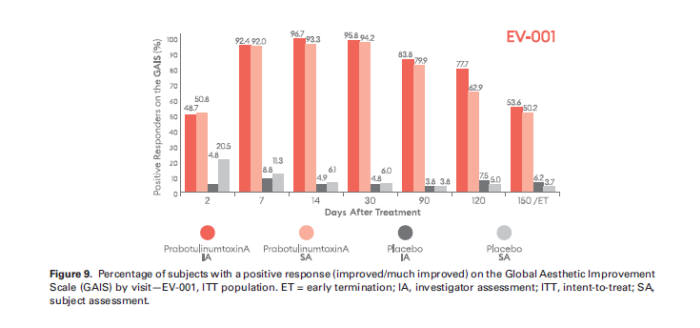
연구 결과는 두 차례 임상에서 시술 후 30일째, 총 4단계 GLS 중 연구자와 피험자가 동시에 2단계 이상 주름이 개선됐다고 응답한 비율이 각각 67.5%와 70.4%로 나타났다. 위약군에서 해당 응답 비율인 1.2%, 1.3%와 극명한 차이를 보여 위약 대비 나보타의 주름개선 효과를 입증했다. 약물 관련 심각한 이상사례는 보고되지 않았다.
미국 3상 임상 연구 책임자이자 이번 논문 제 1 저자인 케네스 비어 마이애미 대학 교수는 “이번 SCI급 논문 게재는 나보타 안전성·유효성을 다시 한번 입증해 향후 보툴리눔 톡신 제품 선택 기준이 될 수 있을 것으로 기대한다”고 말했다.
박성수 대웅제약 나보타 사업본부장은 “글로벌 임상결과에서 입증된 나보타가 권위있는 국제학술지에 게재됨으로써 우수성을 세계적으로 알릴 수 있게 됐다” 며 “앞으로도 다양한 기회를 통해 글로벌 브랜드 위상을 공고히 다져나갈 것”이라고 밝혔다.
성다교 수습기자 dksung@etnews.com







