보건복지부가 3년마다 갱신하는 '혁신형 제약기업' 인증과 관련해 제약 환경을 제대로 반영하지 못한다는 불만이 높다. 연구개발(R&D) 비중에만 인증이 몰려 형평성이 떨어지고 기업의 다양한 사업 구조를 고려하지 못했다.
혁신형 제약기업 인증은 정부가 성장가능성이 높은 제약 산업을 적극 육성하기 위해 R&D 비중이 높은 기업을 인증하는 제도다. 혁신형 제약기업으로 인정되면 약가에서 우대를 받고 정부 과제 참여에 가점과 세제지원 혜택도 주어진다.
문제는 인증 요건 중 매출에 따른 연구개발(R&D)을 절대적으로 따지고 있는 상황에서 벤처 바이오, 국내외 제약사 등 여러 유형 제약 기업 특성을 동일한 기준으로 평가하는 점이다. 현재 인증 기준은 '제약산업 육성 및 지원에 관한 특별볍' 제7조에 따라 의약품 R&D 비용을 의약품 매출로 나눈 값이 1000억원 미만 기업의 경우 7% 이상, 1000억원 이상 기업은 5% 이상에 해당해야 한다.
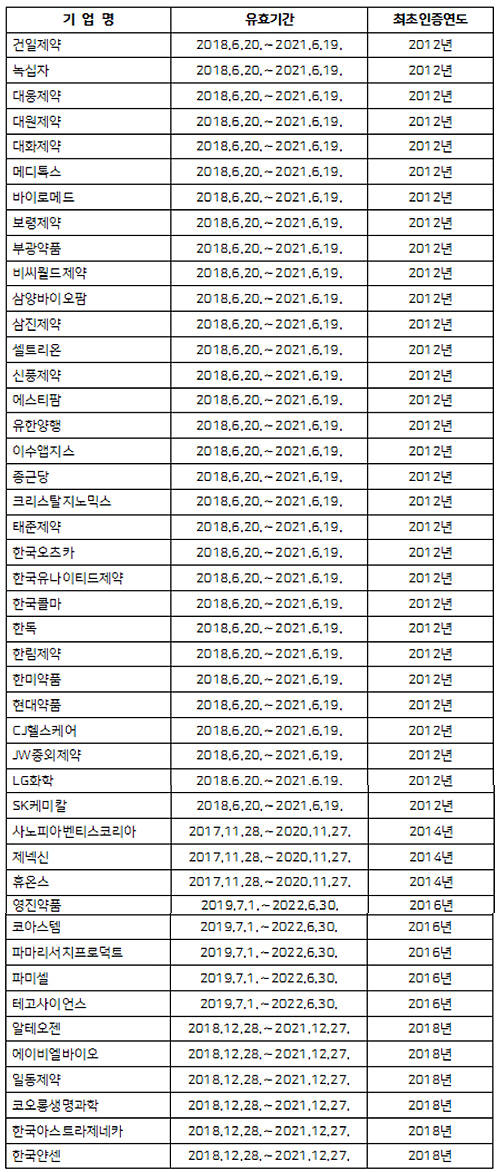
기존 인증을 받은 기업 대부분이 인증 연장을 거쳐 특정 기업 쏠림 현상도 심화되고 있다. 지난해 혁신형 제약기업 인증을 받은 41개사 가운데 31개사는 2021년까지 인증을 연장했고 올해 인증이 만료된 7개 기업 재평가 중 5개 기업이 통과해 기존 현황에서 크게 변화하지 않았다. 오히려 인증 연장에 탈락할 경우 이미지 타격에 영향을 줄 수 있어 기업 부담감만 커진 상황이다.
기업은 인증을 받아도 R&D 지원금이 크지 않고 신약 개발 등 자본이 많이 필요한 부분에 쓰기엔 부족하다는 의견이다. 지난해부터는 R&D 비중 외에 리베이트와 같은 사회적 윤리 기준을 강화해 인증 평가 수준을 맞추기도 까다롭다.
보건산업진흥원은 현 인증제도 평가지표를 개선하고 가이드라인 개발을 위한 연구를 진행 중이다. 혁신형 제약기업의 주력제품의 시장 구조, 사업 방식 등이 다양한 점을 미뤄볼 때, 기업별 사업 구조 특성을 반영한 인증 심사 기준을 도입할 전망이다.
기업 유형별 특성을 반영한 맞춤형 인증심사 기준과 평가위원 구성과 점수 성향에 따른 편차를 보정하는 연구 사업을 추진한다. 기업 유형별에 따른 정량평가 지표와 커트라인 기준 설정 등 심사 기준을 객관화하고 정성평가 항목을 만들어 피평가자가 신뢰할 수 있는 구체적 가이드라인 마련이 목표다.
한 제약 관계자는 “혁신형 제약기업 인증은 제약 산업을 육성하기 위한 인증인 만큼 산업에 초점을 두어 그 기업의 기술력과 혁신성을 따지고 평가하는 기준이 마련되어야 한다”면서 “현재 혁신형 제약기업 인증처럼 R&D 비중만 따질 것이 아니라 실제 R&D 금액, 투명한 재무구조, 혁신적인 기술 개발 등 다양한 평가 기준을 마련해 기업이 납득할 수 있고 지속적인 혁신성을 유인할 수 있는 기준으로 변화해야 한다”고 말했다.
성다교기자 dksung@etnews.com







