식품의약품안전처는 국제의료기기규제당국자포럼(IMDRF) 인공지능(AI) 실무그룹에서 식약처 주도로 개발한 인공지능 의료기기 관련 국제 공통 가이드라인(안)이 29일 공식 승인됐다고 밝혔다.
IMDRF는 의료기기 사전·사후 전주기에 대한 국제 규제 조화·단일화를 촉진하기 위해 구성된 미국 유럽 등 10개국 규제 당국자 간 협의체로 우리나라가 올해 의장국으로 활동하고 있다.
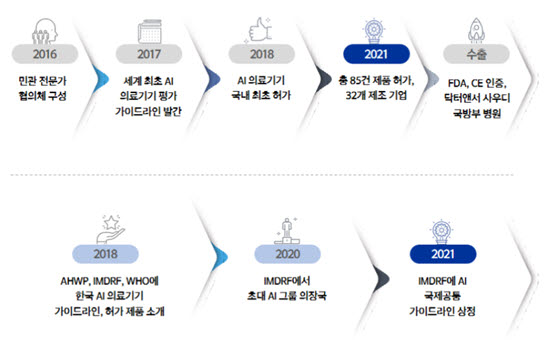
이번 가이드라인(안)은 세계적으로 인공지능 기술을 이용한 의료기기 개발이 급증하며 해당 기술의 규제적용 범위와 규정적 용어 등에 대한 국제조화의 필요성이 제기됨에 따라 식약처가 주도해 개발됐다.
가이드라인은 AI 중 기계학습 기반 의료기기(Machine Learning-enabled Medical Device, MLMD)에 적용된다. 주요 내용은 △의료기기에 활용되는 인공지능 기술의 범위 △대표적인 규정적 용어 정의(12개) △일반적인 AI 개념 설명이다.
우리나라는 IMDRF에 2017년 12월 가입한 10번째 정식회원국으로 식약처는 규제과학 역량을 발휘해 지난해 '인공지능(AI) 의료기기 실무그룹' 결성을 주도했으며, IMDRF 회원국·세계보건기구(WHO)와 함께 세계 최초로 이번 가이드라인(안)을 마련했다.
식약처는 그간 IMDRF 10개 회원국의 규제 당국자와 세계보건기구(WHO), 세계 진단 영상·건강관리 IT·방사선 치료 무역 협회(DITTA), 세계의료기술연합(GMTA) 등 관련 전문기관의 업계 전문가들과 긴밀히 협력해 국제 공통 가이드라인(안) 개발을 추진해왔다.
그 결과 가이드라인(안)이 IMDRF 운영위원회 만장일치로 승인돼 공개의견조회를 위해 IMDRF 홈페이지에 게시됐다. IMDRF 홈페이지에서 올해 11월 말까지 공개로 의견조회를 진행할 예정이며, 의견 수렴 후 내년 3월 최종 발간될 예정이다.
식약처는 IMDRF 의장국과 '인공지능 의료기기 실무그룹' 활동 이전부터 국내 인공지능(AI) 의료기기 제품화 지원을 위해 민간 전문가들과 꾸준히 협업해왔다.
2017년에는 세계 최초로 '빅데이터 및 인공지능 기술이 적용된 의료기기의 허가심사 가이드라인'을 국내에 발간했고 2018년에 국내 최초로 인공지능 의료기기가 허가되어 현재 다수의 제품(총 85건)이 시장에 출시되는 토대가 됐다.
식약처는 “이번에 승인된 가이드라인(안)이 우리나라가 인공지능 의료기기 국제표준을 선도하기 위한 토대가 될 것으로 기대한다”며 “앞으로도 규제과학을 바탕으로 인공지능 의료기기 국제 공통 가이드라인 개발을 주도해 나가겠다”고 밝혔다.
정현정기자 iam@etnews.com









