국내 연구진이 단일분자 형광 이미징 기술을 이용해 차세대 유전자 교정 및 초고감도 유전자 검출 기술에 획기적으로 활용할 수 있는 새로운 유전자 가위 개발의 실마리를 찾아냈다.
광주과학기술원(GIST·총장 김기선)은 이상화 고등광기술연구소(APRI) 책임연구원 연구팀은 Cas12a 크리스퍼 유전자 가위가 단일 촉매 활성 부위만으로 이중 가닥의 DNA를 완전하게 절단하는 분자 기전을 규명했다고 6일 밝혔다.
Cas12a 유전자 가위는 상대적으로 낮은 표적이탈효과, 무차별 단일 가닥 DNA 절단 활성 등과 같은 차별된 특성으로 인해 대표적 유전자 가위인 Cas9을 대신할 수 있는 매력적인 유전자 가위로 각광 받고 있다. 특히 Cas12a 유전자 가위의 무차별 단일 가닥 DNA 절단 활성은 최근 극미량의 특정 염기서열의 핵산을 검출하는 기술에도 활용돼 미국 FDA에 승인된 코로나바이러스감염증(COVID-19) 진단 키트 개발로도 이어져왔다.
하지만 이러한 장점에도 불구, Cas12a 유전자 가위는 Cas9과 달리 DNA 절단 활성을 정교하게 제어하는 기술이 부족해 최첨단 유전자 교정 기술인 염기교정 및 프라임교정에는 제대로 활용되지 못하고 있다.
연구팀은 3년 전 네이처 커뮤니케이션즈에 발표한 이전 연구에서 2개의 촉매 활성 부위로 이중가닥의 DNA를 독립적으로 각각 절단하는 Cas9 유전자 가위와 달리 Cas12a 유전자 가위는 단일 촉매 활성 부위를 통해 표적 DNA의 이중가닥을 순차적으로 절단한다는 사실을 밝혀낸 바 있다. 2개의 촉매 활성 부위 각각의 변이를 통해 DNA 절단 활성을 상대적으로 쉽게 제어할 수 있는 Cas9과 달리 단일 촉매 활성 부위가 표적 DNA의 이중가닥을 순차적으로 절단하는 Cas12a 유전자 가위의 경우 같은 방식으로 DNA 절단 활성을 정교하게 제어하기 어렵다.
이러한 점에서 Cas12a 유전자 가위의 범용성을 높이기 위한 DNA 절단 활성을 정교하게 제어하는 기술을 확보하려면 Cas12a 유전자 가위의 단일 촉매 활성 부위에 의한 완전한 이중가닥 DNA 절단 반응의 핵심 과정과 조절 기전을 밝혀야 했다.

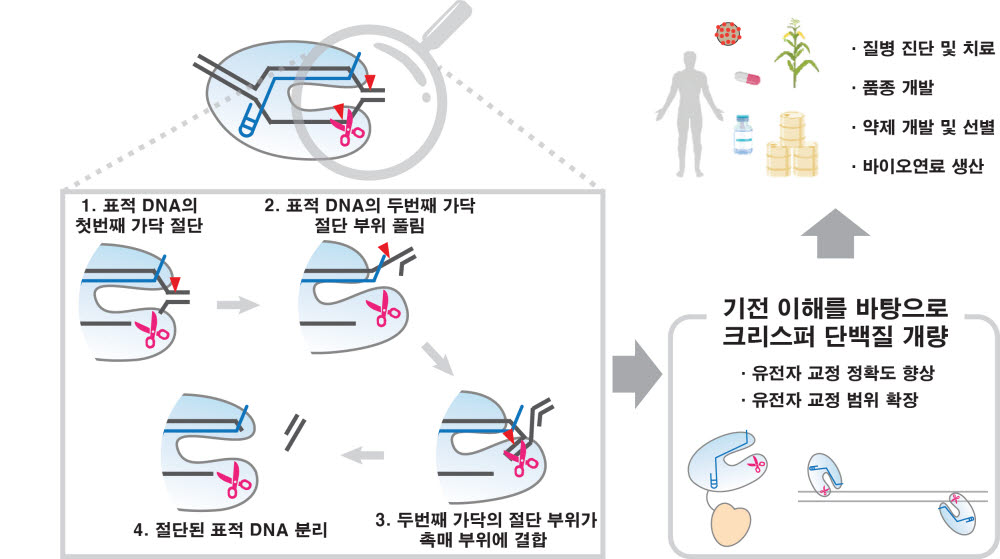
연구팀은 Cas12a 유전자 가위가 단일 촉매 활성 부위로 첫 번째 DNA 가닥을 절단한 후 이중나선 DNA를 완전하게 절단하는 과정에서 일어나는 Cas12a 유전자 가위-DNA 복합체의 구조 변화를 실시간으로 관찰하기 위해서 단일분자 형광 이미징 기술(단일분자 형광 프렛)을 이용하였다. 이를 통해 단일 촉매 활성 부위로 이중나선 DNA 절단을 완성하기 위해서 Cas12a 유전자 가위-DNA 복합체가 두 번의 연속적인 구조 재배열을 한다는 것을 최초로 관찰했다.
특히 표적 DNA 절단에 필수적인 단계가 절단 부위의 국소 풀림이며 이 때 마그네슘 이온이 이 구조를 안정화시키는 결정적 역할을 하는 것을 밝혔다. 이러한 결과는 마그네슘 이온이 촉매 부위의 절단 활성에 기여한다는 기존 이해를 확장하여 마그네슘 이온이 크리스퍼 작동에 필수적인 구조 변화에도 영향을 미친다는 점을 처음으로 제시한 결과다.
연구팀은 향후 이번 연구에서 규명한 기전을 바탕으로 정교하게 DNA 절단 활성이 조절된 다양한 유전자 가위 발굴을 추진할 계획이다.
과학기술정보통신부와 한국연구재단이 추진하는 바이오·의료기술개발사업 및 중견연구지원사업과 지스트 연구원(GRI) 등의 지원으로 수행된 이번 연구의 결과는 세계적인 학술지인 미국 국립과학원회보(PNAS)에 지난 1일 온라인 게재됐다.
광주=김한식기자 hskim@etnews.com