![[스페셜리포트]평가받다 사라질 판…손질 앞둔 혁신의료기술평가](https://img.etnews.com/news/article/2023/08/03/article_03170655436604.jpg)
혁신의료기술은 혁신·첨단 의료기술에 대해 임상 근거 외에도 기술 잠재성을 고려해 평가하는 제도다. 문헌적 근거가 다소 부족해도 혁신 잠재성이 높다고 판단되면 신의료기술 형태로 의료현장에 조건부로 진입해 3~5년 동안 한시적으로 사용할 수 있다. 사용기간이 끝나면 의료현장에서 축적한 근거를 기반으로 유효성 입증을 위한 재평가를 받아야 한다.
인공지능(AI), 디지털치료기기, 정밀의료, 첨단재생의료, 3D프린팅, 로봇 등이 혁신의료기술 신청 대상이다. 혁신의료기기의 경우 동시 검토로 지정되면 혁신의료기술로도 심의 가능하다.
혁신의료기술제도는 의료 결과 향상을 기대할 수 있고 유망 의료기술을 고도화할 수 있는 기반으로 작용해왔다. 검사와 치료 시 침습도를 줄이는 등 환자 불편감은 줄이면서 진단 정확성이나 시술 성공률을 높일 수 있어 환자 만족도와 의료결과 향상을 동시에 꾀하는 효과도 기대된다.
하지만 디지털치료기기(DTx)가 식약처 허가를 받은 뒤 시장 진입을 앞두고 혁신의료기술평가 제도로 인해 출시가 지연되면서 개선 요구가 끊이지 않고 있다.
식약처에서 지난 2월 가장 먼저 허가받은 1호 디지털치료기기 '솜즈'는 실제 시장 출시 예상 시기가 2027년 전후로 예상된다. 품목허가 이후 보건복지부 혁신의료기술로 선정되면 신고-사용-사후평가-급여 여부 결정까지 3~5년이 더 걸리기 때문이다.
특히 혁신의료기술 사후 재평가를 위한 임상근거를 창출하기 위한 '연구수행'과 임상진료 목적의 '임상진료'를 거쳐야 한다는 점에서 업계 불만이 크다. 이 과정에 도달하기 전까지 한국보건의료연구원(NECA) 내 근거창출전문위원회가 요구하는 보완 요청에만 상당한 시간이 걸린다는 지적이 제기된다. 이미 식약처 품목허가를 위해 임상 근거를 제출했는데 또 다시 현실에 맞지 않는 임상 요구와 느린 절차로 인해 시장 출시가 늦어진다는 것이다.
현재 신의료기술평가위원회에는 각 분야별 전문평가위원회가 있다. 근거창출전문위원회는 총 14인으로 임상연구, 의학통계, 법률 등 각 분야 민간 전문가로 구성됐다.
업계 한 관계자는 “보의연 내 근거창출전문위원회 폐지 요구까지 나올 정도로 혁신의료기술 실시를 위한 연구수행과 임상진료 단계 진입 자체가 까다롭다”면서 “디지털치료기기 특성상 1차 의료기관 중심의 대중화가 필요한데 연구수행을 중증질환 중심 3차 의료기관으로 지정한 것도 이해하기 어렵다”고 말했다.
다른 관계자는 “혁신의료기술 실시에서 대상 진료과목을 특정 분야로 한정한 것은 현실을 제대로 반영하지 못한 것”이라며 “디지털치료기기 특성상 정신건강의학과, 신경과뿐만 아니라 내과, 가정의학과 등 다양한 진료과목으로 확산될 필요가 있다”고 주장했다.
해외의 경우 유럽을 중심으로 디지털치료기기의 적극적인 시장 도입과 성장을 뒷받침할 수 있도록 제도가 지속 보완되고 있어 눈길을 끈다.
유럽은 유럽연합(EU) 내 통일된 의료기기 지침(MMD)이 2010년 제정된 후 통합규격 인증마크 도입, 유럽 의료기기규칙(MDR) 제정 등으로 디지털 혁신 의료기기를 안전하게 적용·확산하는 역할을 하고 있다. 특히 독일은 유럽 내 디지털 혁신 의료기기 도입에 대한 변화를 주도하는 국가로 꼽힌다.
독일은 유럽 선진국 중 의료 디지털화 수준이 낮은 편이었지만 디지털치료기기 요건, 처방, 보상 등을 명시한 디지털 처방전 앱(DiGA)을 도입하고 디지털 건강 앱 조례(DiGAV)를 제정하는 등 적극적으로 디지털 헬스케어 확산을 꾀하고 있다. 독일은 디지털치료기기 등재를 위한 요구 조건을 3개월 동안 평가한다. 데이터보호와 정보보안, 품질, 안전성·적합성 기준을 통과하면 임시등재가 이뤄지고 보상도 받을 수 있다. 1년 동안 치료 효과를 검증하면 영구 등재되는 패스트 트랙을 적용한다.
업계에서는 독일이 이같은 패스트 트랙 정책으로 디지털치료기기 활용 기준을 유연하게 적용한 것이 보험시장에 빠르게 진출하는 기반이 됐다고 평가한다. 적절한 보상이 빠르게 이뤄지면서 전체 디지털치료기기 시장 활성화를 이끌고 있다는 것이다.
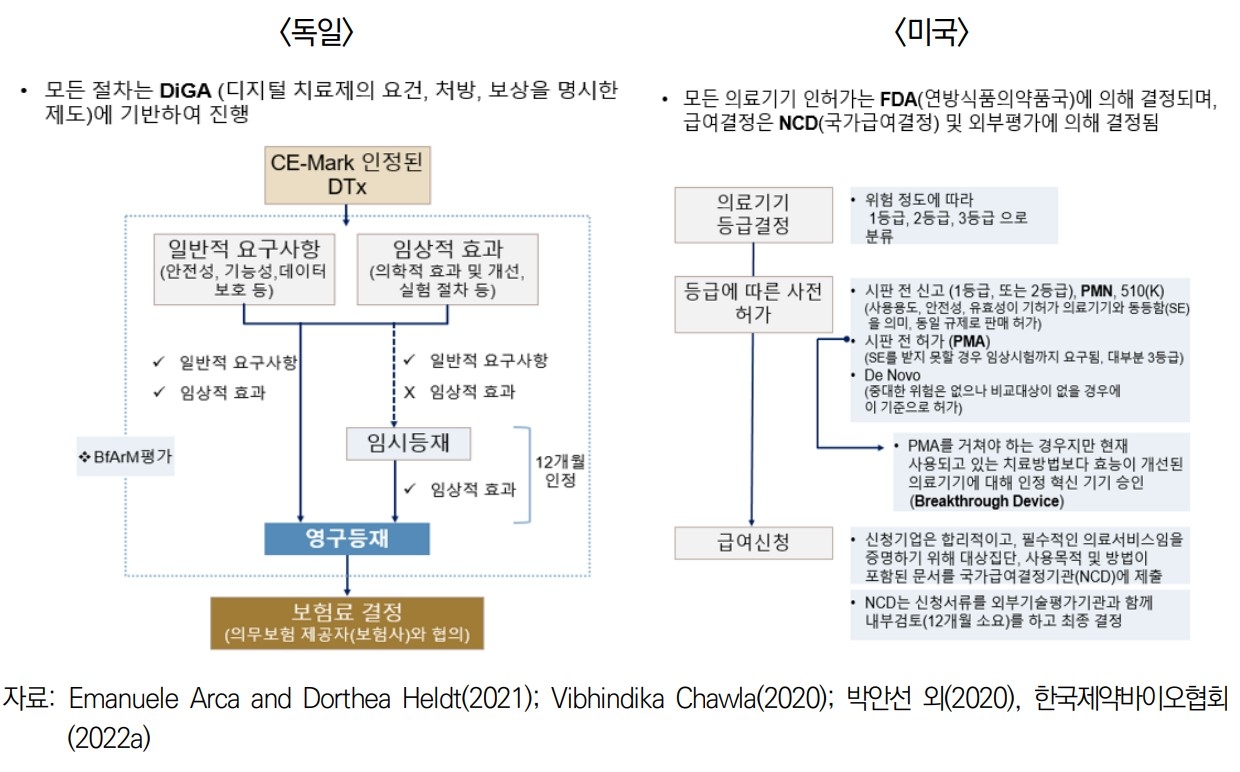
미국은 디지털치료기기를 의료기기로 인허가받도록 해왔으나 2016년 제정한 21세기 치료법안(The 21st Century Cures Act), 2017년 마련한 디지털 헬스 혁신계획(Digital Health Innovation Action Plan)으로 디지털 헬스 제품군에 대한 가이드를 새롭게 제시했다.
미국 식품의약국(FDA)은 기존 의약품처럼 '개별 상품 승인 후 출시'가 아닌 '회사'를 심사해 기업의 안전성·유효성 관리 역량 등을 검토해 인허가 과정을 면제·간소화해주고 있다. 또 디지털치료기기의 신속한 보급을 위해 'Breakthrough Device'로 지정되면 FDA 승인을 받아 시판할 수 있도록 하고 임상시험도 할 수 있도록 했다.
영국은 디지털 헬스케어 관련 가장 큰 조직인 ACC를 중심으로 여러 NHS DIgital, NHS England, NHS Innovation accelerator(NIA) 등 여러 조직이 운영되고 있다. 영국은 디지털치료제 임상시험 자금 지원을 위한 민·관 협력 프로그램(NHS England Test bed Programme)을 운영하고 있다. 또 재정 부담 완화를 위한 프로그램 (MedTech Funding Mandate Policy)으로 국립보건임상연구소(NICE)에서 승인받은 진단, 의료기기, 디지털 제품 등을 지원한다.
배옥진 기자 withok@etnews.com










