한국생명공학연구원(원장 김장성)은 이은우·한백수 박사팀이 한국기초과학지원연구원(원장 양성광)의 황금숙 박사팀과 지방 대사를 조절하는 메커니즘을 활용해, 새로운 난치성 위암 치료 물질 개발에 성공했다고 21일 밝혔다.
이를 통해 항암 내성 위암을 비롯한 다양한 난치성 암 치료 대안이 될 것으로 기대된다.
최근 페로토시스가 항암제 내성암을 비롯한 여러 난치성 암을 사멸시키는 새로운 경로로 주목받고 있다.
페로토시스는 세포 내 철분이 과도하게 축적되면 세포막을 구성하는 인지방질이 활성산소에 의해 과산화돼 세포 내 물질에 영향을 미치고, 이것이 세포막과 미토콘드리아에 손상을 입혀 세포가 죽음을 맞이하는 과정이다.
연구팀은 페로토시스를 항암치료제로 이용하기 위해 페로토시스 유도제와 403개 대사 약물을 혼합해 최적의 조합을 찾았다. 페로토시스 유도제와 포스포라이페이스 A2(인지질 가수분해효소 A2) 억제제 조합이 항암제 내성암을 비롯한 여러 암을 효과적으로 사멸시킬 수 있음을 밝혀냈다.
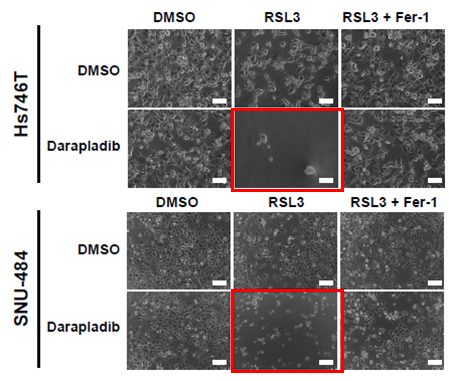
페로토시스 유도제 RSL3(RAS 선택적 치사 3)와 다라플라딥을 함께 사용했을 때 탁월한 사멸 효과가 나타났다.
다라플라딥은 혈관에 지방질이 들러붙는 것을 줄일 수 있다고 알려져 동맥경화증 치료를 위해 개발되다 중단된 신약후보 물질이다.
연구팀은 다라플라딥이 산화된 인지질인 PE를 리소포스파티딜에탄올아민(lysoPE)과 유리 지방산(FFA)으로 분해되는 것을 억제해 페로토시스가 촉진되는 것을 확인했다.
이은우 박사는 “이번 연구는 출연연 간 협력 연구를 통해 세포의 지방질 재편성 경로를 밝혀 새로운 항암치료 전략을 제시한 것”이라며 “특히 관상동맥질환에 대한 임상 3상에서 실패한 다라플라딥과 같이 이미 허가받지 못한 후보물질을 재창출할 수 있는 가능성이 열렸다”고 밝혔다.
황금숙 박사는 ”암세포의 빠른 지질 재편성 경로 규명에 활용된 질량분석기 기반의 지질체 분석 및 대사추적 신기술은 앞으로 난치성 질환의 새로운 치료 타겟 발굴에 핵심적인 역할을 할 것”이라고 말했다.
한편 이번 연구는 9월 15일 세계적인 과학저널인 네이처 커뮤니케이션즈 온라인 판에 게재됐으며, NST 창의형융합연구사업과 과기정통부 원천기술개발사업 및 과학기술분야 기초연구사업, 생명연 주요사업, 기초지원연 주요사업 지원으로 수행됐다.
김영준 기자 kyj85@etnews.com









