광주과학기술원(GIST)은 서지원 화학과 교수팀이 김양미 건국대 시스템생명공학과 교수팀과 공동으로 활성산소를 생성하는 촉매와 세포막을 손상시키는 항균 펩토이드를 결합해 독성이 낮은 항생제를 개발했다고 26일 밝혔다.
1980년대 이후 새로운 작용 기전을 보이는 항생제 개발이 점차 줄어듦에 따라 세계보건기구(WHO)는 다제내성균(여러 항생제에 내성이 있어 감염병 치료를 위해 사용할 수 있는 항생제가 제한적인 세균)에 의한 사망자가 2050년 연간 천만 명에 이를 것으로 추산했다.
특히 그람 음성균의 외막에 있는 지질다당류(LPS)는 투과성 장벽 역할을 함과 동시에 혈류로 방출될 경우 강력한 면역반응을 유발해 생명을 위협하는 패혈증을 일으킬 수 있다. 기존 패혈증 치료를 위한 항생제는 그람 음성균에 대한 내성률이 높아 새로운 작용 기전의 항생제 개발이 필요하다.
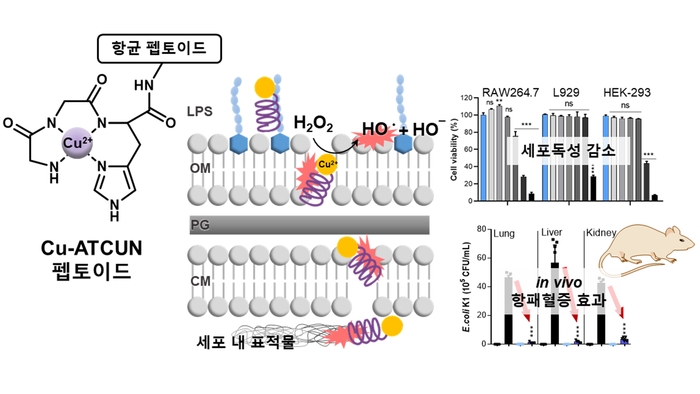
연구팀은 세균의 세포막을 파괴하고 세포 내 여러 소기관 및 유전자 응집을 유도하는 기존의 항균 펩토이드에 강력한 산화 물질인 하이드록실 라디칼을 촉매 반응을 통해 생성하는 '아미노 말단 Cu(II) 및 Ni(II) 결합(ATCUN) 모티프'를 도입해 선택성과 다중 타깃 메커니즘이 향상된 항생제를 개발했다.
항균 활성 및 독성 스크리닝을 통해 유효물질인 '펩토이드 22'를 발굴한 연구팀은 이 물질이 기존 펩토이드의 항균 메커니즘을 유지하며 'Cu-ATCUN 모티프'로 생성된 산화 물질이 박테리아의 DNA 산화와 세포막 지질 과산화를 유도하여 박테리아에 치명적인 산화적 손상을 일으킨다는 사실을 밝혀냈다.
'펩토이드 22'는 기존 펩토이드와 같은 항균 활성을 보이면서도 인체 세포에 대한 독성은 현저히 감소했다. 그람 음성균으로 유도된 패혈증 마우스 모델에서 효과적인 항패혈증 및 항염증 효과를 나타냈으며 간과 폐, 신장을 포함한 주요 장기에 독성을 보이지 않는 것을 확인했다.

서지원 교수는 “이번 연구를 통해 항균 펩토이드의 효과를 극대화하기 위해 산화 공격을 새로운 무기로 사용할 수 있는 방법을 제시했다”며 “박테리아의 항생제 내성 획득을 원천적으로 차단할 수 있는 차세대 항생제 개발에 새로운 가능성을 열었다”고 말했다.
광주=김한식 기자 hskim@etnews.com









