국내 연구진이 알츠하이머 원인 단백질을 분해하는 세포의 대사촉진를 촉진하는 새 치료 전략을 제시했다.
과학기술정보통신부는 묵인희 서울대 교수 연구팀이 뇌 면역세포인 미세아교세포의 대사 조절을 통한 알츠하이머명 치료 가능성을 확인했다고 27일 밝혔다. 이번 연구결과는 세계적 학술지 '셀' 자매지인 '셀 메타볼리즘'에 28일 실렸다.
알츠하이머병은 노인성 치매의 약 70%를 차지하는 질환이다. 뇌 실질에 비정상적으로 축적되는 베타 아밀로이드 단백질에 의해 신경세포가 손상된다. 기억력을 포함한 인지기능이 점진적으로 악화되는 만성 퇴행성 신경질환이다.
미세아교세포는 평상시 주변을 탐지·보수하는 신경교세포다. 베타 아밀로이드 단백질을 감지하면 활성화돼 포식·분해한다. 이때 신경독성을 일으키는 사이토카인도 분비하는 것으로 알려져 있다. 지금까지 알츠하이머병에서 미세아교세포의 정확한 역할과 기전은 알려진 바가 없다.
연구팀은 미세아교세포가 에너지를 생성하는 대사시스템을 실시간으로 확인했다. 알츠하이머병에서 미세아교세포의 보다 근원적인 생리적 역할을 규명했다.
그 결과 알츠하이머병에서 뇌 면역세포인 미세아교세포의 역할과 베타 아밀로이드에 대한 대사학적 반응기전을 확인했다. 또 미세아교세포의 대사촉진을 통해 신경퇴행성 질환의 새로운 치료 전략을 제시했다.
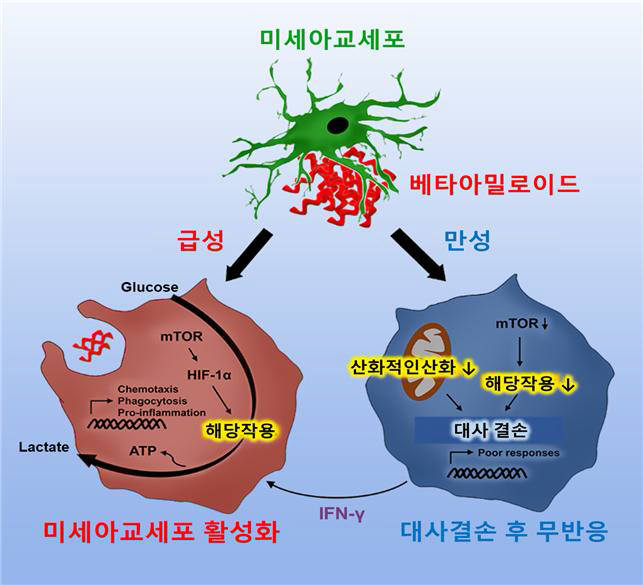
연구진은 베타 아밀로이드 단백질에 급성으로 노출된 미세아교세포는 에너지대사기전이 에너지생성 속도가 느린 미토콘드리아의 산화적 인산화(燐酸化)에서 에너지생성 속도가 빠른 해당(解糖)과정으로 이동하는 대사재편성을 보이는 것을 확인했다. 대사재편성을 통해 단백질 포식작용과 같은 면역기능이 활성화되는 것을 밝혔다.
반면, 만성적으로 베타 아밀로이드에 노출된 치매 뇌 조직에서 미세아교세포는 산화적 인산화와 해당과정이 모두 손상된 대사결손 상태에 이르고, 이로 인하여 면역기능장애가 발생함을 발견했다. 연구진은 대사촉진기능이 알려진 감마인터페론을 유전자변형 치매 마우스에 처리해 대사결손 상태였던 미세아교세포 해당과정을 회복시켜 면역기능을 활성화시켰다. 그 결과 아밀로이드 단백질이 줄어들고, 인지능력 또한 회복됨을 확인했다.
고서곤 과기정통부 기초원천연구정책관은 “글로벌 제약사가 베타 아밀로이드 단백질을 직접 타겟으로 하는 의약품을 개발하다 실패를 거듭하고 있는 상황에서 이번 연구는 뇌 면역세포의 기능회복에 주목했다는 점에 혁신성이 있다”면서 “혁신적 바이오 기술이 국민의 건강한 삶과 경제성장을 열어갈 수 있도록 창의적이고 도전적인 연구활동을 지속적으로 지원해 나갈 것”이라고 말했다.
이번 연구는 과기정통부 뇌과학원천기술개발사업, 중견연구자 사업 및 MRC 집단연구 지원을 받았다.
최호 정책기자 snoop@etnews.com









