한국생명공학연구원(원장 김장성)은 기존 크리스퍼 유전자 가위(CRISPR-Cas12a)의 표적 선택 인식 성질(표적 특이성)을 극대화하는 기술을 개발했다고 2일 밝혔다. 향후 특정 변이 유전자 때문에 발생하는 희귀성 난치 질환, 유전 질환 치료제 개발에 기여할 전망이다.
한국생명공학연구원 소속 이승환 국가영장류센터 박사팀, 김선욱 미래형동물자원센터 박사팀이 이동석 경북대 교수팀과 연구를 수행했다.
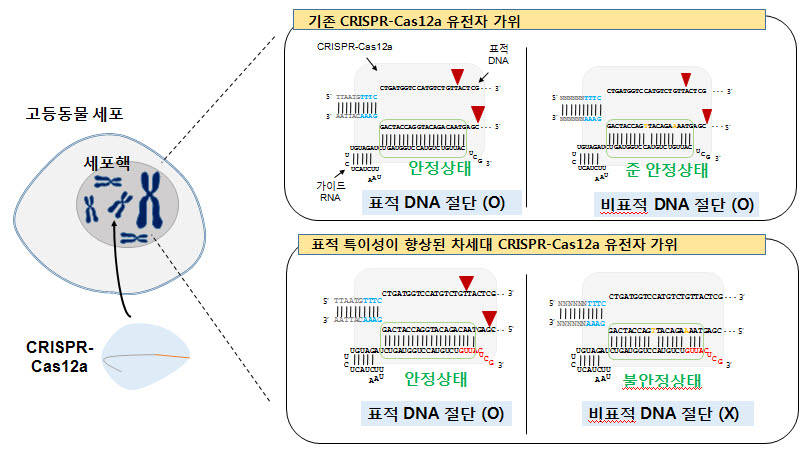
CRISPR-Cas12a 시스템은 박테리아, 고세균에서 발견되는 면역체계의 일종이다. 표적 DNA에 결합해 이중 나선 절단을 유도한다고 알려져 있으며, 생명체 유전체 교정에 보편적으로 사용되고 있다. 그러나 특정 유전자를 의도치 않게 절단하는 문제 탓에 비표적 절단 이슈가 나오고 있다.
연구팀은 CRISPR-Cas12a 구성물 가운데 특정 염기서열 말단을 치환, 비표적 절단을 획기적으로 줄이는 방법을 개발했다. 목표 인식 역할을 하는 가이드 RNA 말단을 DNA로 치환하는 방법을 썼다. 이 경우 가이드와 표적 DNA 사이 결합 에너지에 변화를 주고, 비표적 절단을 현저히 줄일 수 있다. 이미 이를 사용해 다양한 유전자 타겟에서 표적 특이성이 크게 증가함을 확인했다.
연구책임자인 이승환 박사는 “유전자 가위의 표적 특이성이 크리스퍼 유전자 가위 구성물의 특정 염기서열 말단을 DNA로 치환하는 방법을 통해 혁신적으로 증가될 수 있다는 사실을 밝힌 것”이라며 “가이드 RNA를 근간으로 작동하는 다양한 유전자 가위 시스템에 적용될 수 있고, 효율적 암 치료제뿐만 아니라 다양한 유전 질환, 희귀성 난치 질환 등의 유전자 치료제 개발에 안전성 향상이 기대된다”고 밝혔다.
대전=김영준기자 kyj85@etnews.com









