
디지털치료제 전문 개발사 하이는 뇌졸중 후 마비말장애 치료제인 리피치(Repeech)가 식품의약품안전처(이하 식약처)의 확증적 임상허가 승인을 지난 21일 획득했다고 26일 밝혔다.
마비말장애 재활과 관련한 디지털 의료기기로 확증적 임상 승인을 받은 것은 국내 최초다. 하이는 앞서 2021년 12월 범불안장애 치료를 위한 디지털치료제 엥자이렉스(Anzeilax)의 확증적 임상시험을 승인도 받은 바 있다.
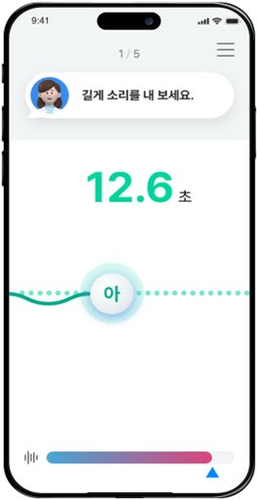
리피치는 마비말장애 환자가 집에서 스스로 자가 언어 훈련이 가능하도록 모바일 애플리케이션 기반으로 개발됐다. 언어 훈련과 동시에 얻어지는 환자의 음성을 분석해 소리 정확도, 피치, 소리 크기, 발성 길이, 조음 등 실시간 피드백이 가능하다. 환자의 장애 심각도에 적합한 재할 프로그램을 추천하도록 설계했다. 하이는 400시간 이상의 마비말장애 환자 음성 데이터를 수집하고 음성 언어정보에 대한 음향 및 음성적 특징 데이터 전처리 및 딥러닝 알고리즘을 개발했다.
마비말장애는 뇌졸중 환자의 약 50%가 겪는 장애이다. 건강보험심사평가원의 질병통계에 따르면 뇌졸중 환자는 2015년 약 54만 명 대비 2019년 62만 명으로 약 13% 증가한 것으로 나타났다. 마비말장애 환자의 언어치료는 종합병원이나 재활병원에 집중돼 장기간 치료 혜택을 받기 어렵고 일대일 치료와 비급여로 진행돼 비용 부담이 높다.
리피치가 상용화되면 재활 환자들에게 비용 부담을 덜어줄 수 있다. 이용의 편리성 면에서도 직접적인 도움이 될 것으로 기대된다.
하이는 리피치의 글로벌 서비스에도 전력을 기울이고 있다. 하이는 지난해 미국 보스톤에 위치한 MGH 보건전문대학원과 리피치의 미국내 확증적 임상시험 진행 계약을 체결하고 하반기 임상 시험 시작을 목표로 하고 있다.
김진우 하이 대표는 이번 확증적 임상 승인에 대해 “지난 3년간 이대 서울 병원의 송태진 교수와 함께 이룩한 노력의 결과라고 생각한다”라며 “기존 연구자 임상에서 증명된 결과를 기반으로 하루 빨리 확증적 임상 및 식약처 품목허가를 획득해 마비말장애로 어려움을 겪고 있는 환자의 재활에 조금이라고 기여하고 싶다”라고 밝혔다.
송혜영 기자 hybrid@etnews.com









