식품의약품안전처는 세계 최초로 '생성형 인공지능(AI) 의료기기 허가·심사 가이드라인'을 제정·발간했다고 24일 밝혔다.
이 가이드라인은 생성형AI 의료기기에 해당하는 사례를 제시하고 허가신청서 작성 방법과 제출자료를 안내한다.
의료영상 판독, 진단 보조, 치료 계획 수립 등 다양한 영역에서 활용될 수 있는 생성형AI는 데이터 편향, 정확성 부족, 윤리적 문제 등이 제기될 우려가 있어 이를 고려해 안전성·유효성을 평가할 필요가 있다.
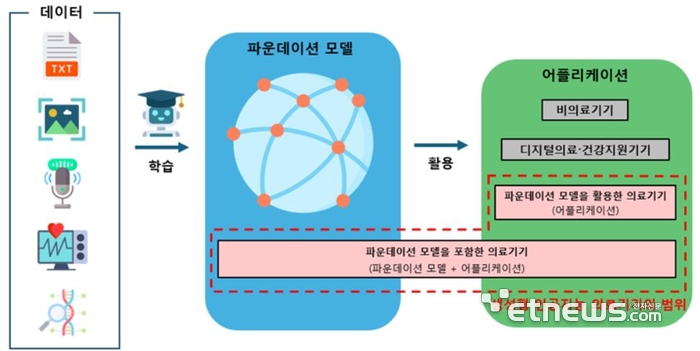
식약처는 지난해 3월부터 학계·의료계·산업계 전문가와 함께 협의체를 구성하고 생성형AI 관련 최신 기술·규제 동향을 조사·논의했다. 이를 바탕으로 생성형AI 의료기기 개발부터 허가 후 관리까지 전 주기 위험 요인을 분석해 허가심사 시 고려해야 할 사항을 마련했다.
이와 함께 식약처는 독립형 디지털의료기기소프트웨어에 대한 '사용적합성 자료'를 상세하게 안내하는 가이드라인도 이날 제정·발간했다.
독립형 디지털의료기기소프트웨어는 전자·기계장치 등 하드웨어에 결합하지 않고 범용 컴퓨터 등과 동등한 환경에서 운영되며 그 자체로 디지털의료기기에 해당하는 독립적인 형태의 소프트웨어를 의미한다.
이 가이드라인에선 허가(인증)신청서 및 사용적합성 요약서에 대한 작성 기준·요령을 상세한 예시를 활용해 설명하고, 변경허가(인증) 대상과 사용적합성 관련 위해정보 수집 방법 등도 안내한다.
가이드라인에 대한 자세한 내용은 식약처 홈페이지에서 확인할 수 있다.
오유경 식품의약품안전처장은 “이번 가이드라인이 국내 인공지능 활용 의료기기 개발에 도움을 줄 것으로 기대한다”며 “앞으로도 선제적이고 투명한 규제 체계를 마련하는 동시에 국내 기업이 글로벌시장에서 경쟁력을 확보할 수 있도록 국제 규제 조화를 위한 규제외교도 적극 추진해 나갈 계획이다”고 말했다.
정용철 기자 jungyc@etnews.com










