시지바이오는 자사 척추유합술용 차세대 골대체재 '노보시스 퍼티'가 지난 17일 미국 식품의약국(FDA)으로부터 임상시험계획 승인(IDE)를 받았다고 21일 밝혔다.
이번 승인으로 시지바이오는 미국 시판 허가(PMA)를 위한 마지막 임상 절차인 확증임상을 본격적으로 돌입하게 됐다. 특히 '노보시스 퍼티'는 한국에서 개발된 바이오융복합 의료기기 가운데 최초로 미국 FDA로부터 확증임상 승인을 받았다.
IDE 승인은 의료기기를 사람을 대상으로 시험하기에 앞서 미국 내에서 FDA의 정식 허가를 받아야 하는 절차다.
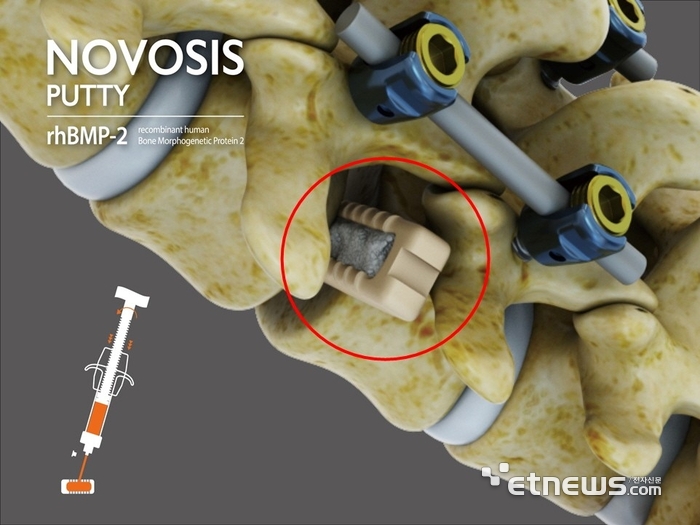
노보시스 퍼티는 기존 대표 제품인 '노보시스(NOVOSIS)'를 기반으로 개발한 차세대 골대체재다. 성형성을 부여하는 미네랄 기반의 트리칼슘포스페이트(TCP)를 HA와 함께 적용한 이중 지지체 구조로, 성형 가능한 점성형(퍼티 제형)으로 설계돼 수술 부위에 맞춰 사용이 가능하다. 특히 새로운 뼈 생성을 돕는 골형성 단백질(rhBMP-2)의 방출 속도와 효율을 정밀하게 조절할 수 있도록 했다.
시지바이오는 현재 일본 파트너사인 니혼조끼를 통해 일본 현지에서도 노보시스 퍼티 제품에 대한 허가용 임상시험을 진행하고 있다. 최근 일본에서 임상 1/2상을 성공적으로 완료했다. 노보시스 퍼티는 이번 IDE 승인을 기점으로 유럽, 호주 등 주요 시장에 대한 허가 및 사업 확대도 본격화할 계획이다.
유현승 시지바이오 대표는 “이번 IDE 승인 획득은 시지바이오가 수년간 축적해온 기술 기반 개발 전략의 중요한 결실”이라며 “특히 미국 내 바이오융복합 골대체재 시장은 진입장벽이 매우 높은 분야로, 이번 승인 자체가 시지바이오의 기술력과 노보시스 퍼티 제품 경쟁력을 국제적으로 다시 한번 입증한 사례”라고 말했다.
정용철 기자 jungyc@etnews.com









