관련 통계자료 다운로드 유전자재조합의약품 허가 및 임상시험 승인신청 건수
관련 통계자료 다운로드 유전자재조합의약품 허가 및 임상시험 승인신청 건수
표적치료가 가능하고 부작용이 합성의약품보다 적은 항체의약품 연구개발(R&D)이 활기를 띠고 있다. 정부는 항체의약품 평가 가이드라인을 만들어 지원할 계획이다.
식품의약품안전처는 최근 3년간 유전자재조합의약품 허가, 임상시험 승인 신청 건수를 분석한 결과 항체의약품이 가장 많았다고 밝혔다. 유전자재조합의약품은 유전공학 기술을 이용해 살아있는 세포에서 생산한 단백질을 주성분으로 하는 의약품이다. 종류에는 항체의약품·사이토카인·호르몬 제제 등이 있다. 가장 많은 허가·임상시험 승인 신청을 한 항체의약품은 질환 원인이 되는 특정 부위에만 결합하는 항체를 유전자재조합기술로 제조한 의약품이다.
유전자재조합의약품 개발동향과 관계있는 신규 임상시험 승인 신청 현황을 살펴보면 2010년 72건, 2011년 87건, 2012년 107건으로 증가하는 것으로 나타났다. 수입제품은 각각 52건, 62건, 90건으로 증가했으며 국내 개발은 20건, 25건, 17건으로 조사됐다. 종류별로는 항체의약품의 건수가 2010년 48건(67%), 2011년 57건(66%), 2012년 80건(75%)으로 가장 많았다.
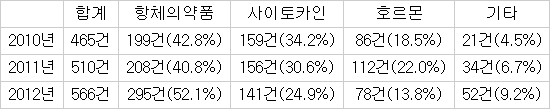
유전자재조합의약품의 허가와 임상 등 전체 민원 접수 건수는 2010년 465건, 2011년 510건, 2012년 566건으로 매년 지속 증가했다. 항체의약품은 연도별로 199건(43%), 208건(41%), 295건(52%)으로 가장 많았으며 그 뒤로 사이토카인, 호르몬제제 등의 순이었다. 항체의약품은 2010년 항암제와 관절염 치료제가 대부분이었지만 2011년과 지난해는 천식·골다공증·치매 등 효능으로 개발이 확대되고 있다.
식약처는 “유전자재조합의약품 중 항체의약품의 개발 비중이 높은 이유는 표적치료가 가능해 치료 효과가 좋으면서도 부작용이 합성의약품에 비해 상대적으로 적기 때문”이라고 밝혔다.
식약처는 유전자재조합의약품 중 개발이 활발한 항체의약품 개발에 대한 지원이 필요해 올해 하반기에 `항체의약품 바이오시밀러의 비임상 및 임상 평가 가이드라인`을 제정 등 개발 추세에 맞춰 지속적인 지원할 계획이다.
권동준기자 djkwon@etnews.com